2023年9月,bat365官网登录附属东方医院血液内科施菊妹教授团队在《Haematologica》(IF=10.1)在线发布了题为“Ribosomal protein S3 mediates drug resistance of proteasome inhibitor: potential therapeutic application in multiple myeloma”的研究论文。

该研究揭示了RPS3作为一种新型的肿瘤生物标志物和治疗新靶点,在介导MM耐药性中的重要作用和分子机制,并申请了国家发明专利。
多发性骨髓瘤(Multiple myeloma,MM)是一种起源于B细胞系的血液系统恶性肿瘤,特征为单克隆浆细胞在骨髓中异常增生,分泌大量的单克隆免疫球蛋白或轻链(M蛋白),并诱导相关器官损伤,即“CRAB”症状[高钙血症,肾功能损害,贫血、骨病]以及继发淀粉样变性等相关表现。MM是血液系统第2大常见的恶性肿瘤,约占血液系统恶性肿瘤的10%,患者预后差,中位生存期仅约5~6年。其中,临床耐药极大限制了MM患者的无进展生存期和总生存期的改善,是目前复发/难治MM治疗中面临的最棘手的问题之一。
RPS3是真核生物核糖体40S亚基的重要组成部分,可直接参与核糖体的成熟和翻译起始过程 。近几年研究发现,RPS3可作为核因子κB(NF-κB)的非Rel亚基,与NF-κB-Rel蛋白协同参与特异性NF-κB-靶基因的转录,从而调控如细胞存活、凋亡、放射抗性和B细胞中免疫球蛋白κ轻链基因的表达等多种生理过程。该项研究首次揭示了RPS3在血液恶性肿瘤中的转化应用前景,并申请了国家发明专利。研究发现:RPS3在MM中高表达,并且RPS3的过表达导致MM中蛋白酶体抑制剂的耐药性,与MM的生存率呈负相关。机制研究发现:RPS3的磷酸化水平受MM关键基因甲状腺激素受体相互作用分子13(TRIP13)的调控;TRIP13通过丝氨酸-苏氨酸蛋白激酶PKCδ调控RPS3 T221位点的磷酸化,激活经典的NF-κB信号通路,诱导MM细胞的存活和耐药。此外,联合施教授研究团队自主研发的首个靶向TRIP13的特异性小分子抑制剂DCZ0415,发现DCZ0415通过抑制TRIP13/PRS3/NF-κB信号通路轴对耐药MM表现出强烈的细胞毒性。值得注意的是,该项研究通过体外和动物体内实验首次揭示了小分子抑制剂DCZ0415与MM一线化疗药物硼替佐米在耐药MM中具有高度的协同抗肿瘤作用,可有效增强耐药MM细胞对硼替佐米的敏感性。
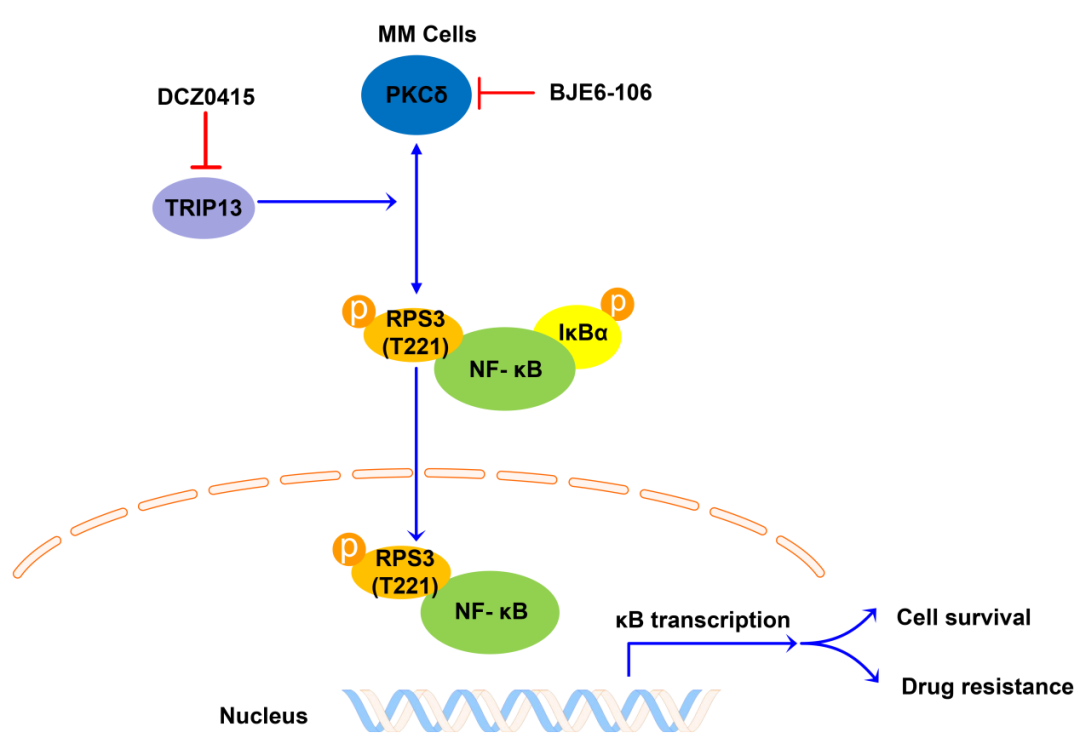
综上,该项研究首次揭示了RPS3作为一种新型的肿瘤生物标志物和治疗新靶点,通过参与TRIP13介导的NF-κB通路激活调控MM的耐药性,并通过体外以及动物体内模型中证实联合靶向TRIP13/PRS3/NF-κB信号通路轴和MM一线化疗药物硼替佐米能够协同抵抗耐药MM,为复发/耐药MM患者的治疗提供新思路,具有潜在的临床应用和转化前景。
bat365官网登录附属东方医院血液内科施菊妹教授、中国科学院上海药物研究所朱维良教授为共同通讯作者,bat365官网登录附属东方医院血液内科专家陈格格、高学洁为共同第一作者。该项目获得国家自然科学基金和上海市青年科技英才扬帆计划等基金的支持。